光学纯的双芳基醇是一类重要的手性砌块化合物,该类化合物具有两个大位阻的芳香侧链,通常被称为“难还原”酮类。
来自Kluyveromyces polyspora的醇脱氢酶KpADH在还原4-氯苯基-吡啶-2-基甲酮时表现出了较高的转化率和中等的立体选择性(82% ee, R)。在此基础上,江南大学倪晔教授团队与中科院上海有机所周佳海研究员合作开展了对KpADH进行立体选择性改造及催化机制解析的深入研究。针对底物具有两个大位阻芳环的特点,作者提出了“极性扫描”策略(polarity scanning),分别使用天冬酰胺Asn和缬氨酸Val作为极性和非极性筛子,通过定点突变获得了KpADH底物结合口袋上与酶催化立体选择性相关的6个重要氨基酸位点;之后作者对这些位点进行迭代组合突变,成功获得立体选择性显著提高的突变株Mu-R2(99.2% ee,R)和立体选择性翻转的突变株Mu-S5(97.8% ee,S)。
为研究酶催化的立体选择性识别机制,作者对野生型KpADH及两个突变体进行蛋白质结晶和晶体结构解析,发现214位点的突变导致野生型和突变体的蛋白质结构在Loop82-96区域存在明显差异。根据醇脱氢酶的反应机制及过渡态分析,选择距离参数d (O14CPMK-H9Y164) ≤3.4 Å 和d (C7CPMK-H4NPH) ≤4.5 Å衡量突变体与底物进入催化中心时的两种取向是否可形成预反应状态,结果表明Mu-R2-CPMKProR及Mu-S5-CPMKProS更易达到预反应状态。
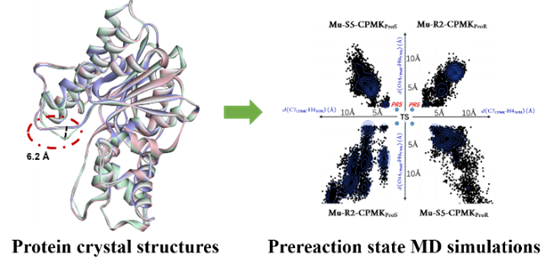
图1. 基于KpADH及其突变体蛋白晶体结构的预反应状态分析
约束条件下的动力学模拟结果显示,对于突变体Mu-S5,其底物结合口袋入口处突变位点N136,V161,C237和G214的α-碳原子可形成类平面的“极性门”。由于底物潜手性碳两侧氯苯环和吡啶环的带电差异,在催化过程中底物的方向在其穿过“极性门”时即被决定。对于野生型KpADH,类似的平面被周围芳香族氨基酸残基的侧链阻挡,从而使底物在接近催化中心时无法保持单一方向。
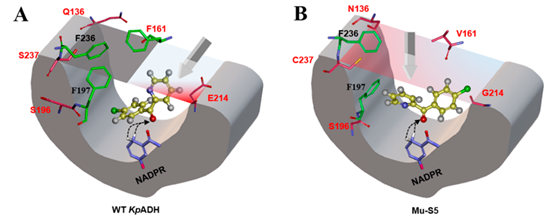
图2. 分子动力学模拟揭示KpADH立体选择性识别的关键机制-“polar gate”
基于极性的筛选策略和基于蛋白质晶体结构的计算机模拟是本文研究的亮点。极性筛选策略可用于高立体选择性醇脱氢酶的构建,为制备光学纯双芳基醇提供了高效的生物催化剂;合理的计算机模拟加深了研究者对双芳基醇脱氢酶立体选择性催化机制的理解,为蛋白质工程用于新酶的理性设计提供了理论基础。研究成果以Structural Insight into Enantioselective Inversion of an Alcohol Dehydrogenase Reveals a “Polar Gate” in Stereorecognition of Diaryl Ketones为题发表于美国化学学会期刊 Journal of the American Chemical Society。江南大学博士生周婕妤为论文的第一作者。晶体结构解析和计算模拟相关工作得到了江南大学饶义剑教授和上海交通大学赵一雷教授的大力帮助。
研究成果以Structural Insight into Enantioselective Inversion of an Alcohol Dehydrogenase Reveals a “Polar Gate” in Stereorecognition of Diaryl Ketones为题发表于美国化学学会期刊 Journal of the American Chemical Society (2018), 140: 12645-12654。
附原文链接:https://pubs.acs.org/doi/pdf/10.1021/jacs.8b08640
如果您无法在线浏览此 PDF 文件,则可以
下载免费小巧的 福昕(Foxit) PDF 阅读器,安装后即可在线浏览 或
下载免费的 Adobe Reader PDF 阅读器,安装后即可在线浏览 或
下载此 PDF 文件